Гепатологія – 2010. – № 1. – С. 21–27.
Сучасна клініко-патогенетична класифікація порушень обміну заліза (рис.1) виділяє дві основні форми сидерозу – гемосидероз (депозити гемосидерину накопичуються переважно у клітинах ретикуло-ендотеліальної системи) та гемохроматоз (гемосидерин накопичується переважно у гепатоцитах).
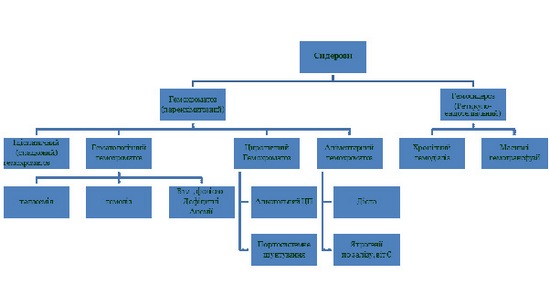 Рисунок 1. Класифікація порушень обміну заліза (сидерозів).
Рисунок 1. Класифікація порушень обміну заліза (сидерозів).
У випадку хронічного гепатиту С (ХГС) найбільше значення щодо гепатотоксичної та фіброгенної дії, прогнозу ПВТ, безперечно, має власне паренхіматозний гемохроматоз [1]. За домінуючим механізмом розвитку гемохроматоз поділяють на 4 групи: ідіопатичний спадковий, гематологічний, циротичний або алкогольний та аліментарний. Гематологічний гемохроматоз розвивається внаслідок анемій різного генезу (гемолітична, В12-, фолієводефі-цитна, при таласемії). Циротичний гемохроматоз розвивається на тлі вже сформованого ЦП алкогольної етіології або після портосистемного шунтування, крім того алкоголь має властивість посилювати засвоєння заліза гепатоцитами. Аліментарний гемохроматоз є наслідком надмірного споживання багатих на залізо продуктів, власне препаратів заліза та надмірного вживання вітаміну С, який теж посилює засвоєння заліза [2].
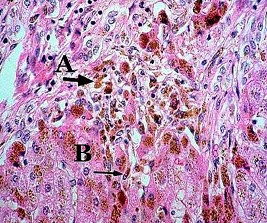 Рисунок 2. Морфологічні ознаки гемосидерозу.
Рисунок 2. Морфологічні ознаки гемосидерозу.
Золотисто-коричневі відкладання гранул гемосидерину у купферівських клітинах (А) та портальних макрофагах (В)
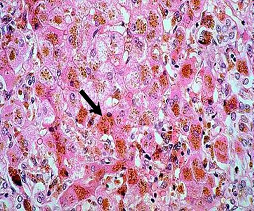 Рисунок 3. Морфологічні ознаки гемохроматозу [Стрілкою показані гранули гемосидерину у гепатоцитах].
Рисунок 3. Морфологічні ознаки гемохроматозу [Стрілкою показані гранули гемосидерину у гепатоцитах].
На нашу думку, найскладніші порушення обміну заліза при хронічному гепатиті С пов’язані саме із спадковою формою гемохроматозу (Hereditary Hemochromatosis, HHC). Він не завжди яскраво маніфестує, тому погано діагностується і ще гірше лікується.
Сучасний погляд на патогенез ідіопатичного HHC провідну роль відводить мутації С282Y у гені гемохроматозу. Описані і інші мутації, однак їх зв’язок з розвитком HHC не доведений [3]. Помічено, що ця мутація найчастіше виникає в осіб з А3 генотипом основного комплексу гістосумісності (HLA). Проте, наявність такої мутації зовсім не обов’язково супроводжується розвитком гемохроматозу [4, 1].
Є фактори, які стимулюють експресію дефектного гену – в першу чергу це HCV-інфекція, алкоголь, надмірне поступлення заліза [2]. З іншого боку, зменшення навантаження залізом, в тому числі при крововтратах, сповільнює розвиток HHC. Можливо, саме завдяки регулярним крововтратам та меншому споживанню алкоголю, порівняно з чоловіками, жінки мають кращий прогноз щодо SVR під час ПВТ ХГС.
Інше захворювання, розвиток якого ініціюється HCV-інфекцією – це пізня шкірна порфірія (Porphyria cutanea tarda, PCT). Схильність до PCT теж пов’язують з мутацією у гені гемохроматозу [3], PCT, як і HHC, супроводжується синдромом перевантаження залізом [5]; тригерними факторами теж є вірус гепатиту С, алкоголь та інсоляція [6, 7].
Класифікація порфірій враховує домінуючий механізм порушення порфиринового обміну (таблиця1). При ХГС найчастіше розвивається PCT.
Таблиця 1. Патогенетична класифікація порфірій.
| Дефіцит ферменту | Захворювання |
| d-амінолевулінової кислоти синтетаза | ALA-порфірія |
| а-амінолевулінової кислоти дегідратаза | |
| порфобіліноген деаміназа | Гостра інтермітуюча порфірія |
| Уропорфіриноген ІІІ косинтетаза | Вроджена еритропоетична порфірія |
| Уропорфіриноген декарбоксилаза | Пізня шкірна порфірія, гепатоеритропоетична порфірія |
| Копропорфіриноген оксидаза | Спадкова копропорфірія |
| Протопорфіриноген оксидаза | Варієгатна (змішана) порфірія |
| Феррохелатаза | Еритропоетична протопорфірія |
У наших спостереженнях такі пацієнти зустрічаються доволі часто. Частота PCT при ХГС, за нашими даними, складає 20% з числа позапечінкових проявів та 3% – з числа усіх HCV-інфікованих.
Опорними симптомами PCT є фотосенсибілізація шкіри, підвищена ламкість епітелію, еритеми, ерозії, бульозні елементи, гіпертріхія та гіперпігментація обличчя, червоний колір сечі за рахунок уропорфиринів. Нерідко ураження шкіри є основною скаргою, з приводу якої пацієнти звертаються за медичною допомогою, а ХГС діагностується лише при їх подальшому обстеженні. У деяких з пацієнтів, що звернулись в нашу лікарню після безуспішного лікування в дерматологічних відділеннях, вперше було діагностовано і, власне, PCT.
Можна констатувати низьку обізнаність лікарів різних спеціальностей з цією нозологією. Немає єдності і серед гематологів та гепатологів щодо поглядів на патогенез, алгоритм діагностики та принципи лікування PCT [8, 4]. Невелика кількість спостережень, мультифакторність цієї нозології, різні HLA-генотипи хворих, відмінності у генотипі вірусу HCV та у вірусному навантаженні, відмінні терміни інфікування ускладнюють формування достатньо репрезентативних груп хворих для дослідження закономірностей розвитку, перебігу та оптимальних схем терапії PCT [9].
Та одного разу до нашої уваги потрапив унікальний випадок. Нам вдалось спостерігати перебіг PCT на тлі ХГС у двох однояйцевих близнюків. Унікальність випадку полягає ще й у тому, що інфікування братів відбулось одночасно, зі спільного джерела, спільним генотипом вірусу HCV. В обидвох близнюків розвинулась і PCT.
Хворі О. та А., однояйцеві близнюки чоловічої статі, віком 42 роки, у дитячому віці були одночасно інфіковані вірусом гепатиту С під час гемотрансфузії з приводу Rh-конфлікту та наступної гемолітичної анемії. Тривалість персистенції збудника – 42 роки, генотип вірусу – 1 b. HLA-фенотип обидвох близнюків – А2;А3;В41;В15. За наявністю ізогемаглютиногенів системи АВО в обидвох пацієнтів 0(І) група крові. Спадковість не обтяжена, інформація про випадки PCT у попередніх поколіннях – відсутня. Маніфестних форм гострого гепатиту або інших епізодів жовтяниці (окрім гемолітичної) в анамнезі життя не констатували. Найперші ознаки захворювання, що послужили причиною звернення за медичною допомогою хворого О., з’явилися наприкінці 1999 року (через 35 років після інфікування): виражена слабкість, втомлюваність, підвищена ламкість шкіри, еритеми, поодинокі ерозії на обличчі. Захворювання швидко прогресувало: чітко вималювалась залежність між ступенем уражень шкіри та фотосенсибілізацією, ламкість шкіри посилилась, десквамація епітелію відбувалась при найменших травмах, з’явились булльозні елементи та ерозії на тильній стороні кистей рук, надмірне оволосіння та гіперпігментація обличчя, сеча набула червоного забарвлення.
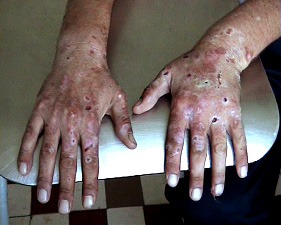 Рисунок 4. Ураження шкіри кистей рук при PCT у хворого О.
Рисунок 4. Ураження шкіри кистей рук при PCT у хворого О.
Лікування у дерматологічному відділенні не принесло відчутного ефекту. Подальше обстеження дозволило виявити підвищення активності АлАТ у 2-3 рази, з приводу чого з підозрою на вірусний гепатит хворий був скерований на консультацію до інфекціоніста. Припущення підтвердились виявленням сумарних антитіл до вірусу гепатиту С. Подальші обстеження: HВ–150 г/л, еритроцити-4,5× 1012/л, Le – 6× 109/л, ШОЕ-4 мм/год, заг. Білірубін – 30 мкмоль/л, прямий-10,2 мкмоль/л, АлАТ – 2,0 ммоль/л, тимолова проба – 1,2 од., білок – 75г/л, альбуміни – 44%, глобуліни – 56%, a 1 – 2,0, a 2 – 10,3, b – 17,3, g – 26,4%; цукор крові – 3,8 ммоль/л, копропорфирини сечі – 460 нмоль/добу (N=0-70), уропорфирини сечі – 14846 нмоль/добу (N=0-80), HВsAg – негативний; Anti-HCV – позитивні, HCV-RNA – позитивна, високе вірусне навантаження, генотип HCV – 1b.
Враховуючи, що PCT може бути частою і ранньою ознакою спадкового гемохроматозу, проведено додаткові обстеження: сироваткове залізо – 16,3мкмоль/л (N=9-27), ферити – 219мкг/л (N=10-200); біопсія печінки: балкова будова помірно порушена, гепатоцити неоднорідні за формою та розмірами, реакція Перлса позитивна – майже всі гепатоцити містять дрібнозернисті депозити залізовмісного пігменту; одночасно залізовмісні депозити містяться лише в поодиноких купферовських клітинах (що виключає вторинну природу гемосидерозу). Отже, на підставі клініко-лабораторних та інструментальних обстежень було встановлено діагноз “Хронічний гепатит С 1b генотип, високе вірусне навантаження, ступінь A2F3 (METAVIR) з мінімальновираженим цитолітичним синдромом та позапечінковими проявами – пізня шкірна порфірія, первинний гемохроматоз”.
Патогенетичне лікування хворого О. із використанням унітіолу, делагілу, концентрованої глюкози, метіоніну, карболену, засобів місцевого застосування та періодичних флеботомій було ефективним, але досягнутий результат був не стійким. Можливо, використання аргінату гему (нормосанг) дозволило би отримати стабільніший результат, але, на жаль, в Україні цей препарат не зареєстрований і не має вітчизняних аналогів.
У процесі обстеження та збору анамнезу життя з’ясовується, що брат-близнюк А. даного пацієнта теж страждає на захворювання з подібними ознаками ураження шкірних покривів. Поінформований про хворобу брата, він, у свою чергу, проходить обстеження, результати яких мало відрізняються від братових: високий вміст гемоглобіну, гіперхромія еритроцитів, помірно сповільнена ШОЕ (внаслідок еритроцитозу), невисока тимолова проба всупереч вираженій диспротеїнемії, високий вміст копро- та уропорфиринів у сечі, наявна HCV-віремія. Проте гіперферментемії та гіпербілірубінемії, на відміну від брата О., у динаміці спостереження не виявлено, що, однак, не може свідчити про ступінь активності гепатиту. Пункція печінки не виконувалась. Відмінності в умовах життя та роботи близнюків зумовили особливості клінічного перебігу ПШП: хворий О., працюючи фермером, піддавався більш інтенсивній інсоляції, ніж його брат-підприємець, що позначалось масивнішими ураженнями шкіри обличчя, рук. Натомість найбільші загострення PCT у хворого А. можна було пов’язати з епізодами зловживання алкоголем.
Що ж було відмінного між цими випадками, що дає нам право порівнювати їх, а не сприймати як єдиний, у силу своєї ідентичності, випадок? Згадуючи основні механізми патогенезу PCT та HHC, можна сказати, що фактори вірусу та пацієнта у даному спостереженні є повністю ідентичні, а ось вплив екзогенних чинників, і, в першу чергу, противірусної терапії, може бути визначальним у поясненні відмінностей перебігу PCT у хворих О. та А..
З метою елімінації основного екзогенного порфіриногенного чинника – вірусу HCV хворому О. було проведено курс етіотропної терапії ХГС: альфа2b -інтерферон 3 млн МО 3 р/тиждень + рибавірин 1000-1200 мг протягом 12 місяців. В результаті отримано стабільну нормалізацію активності АлАТ, відсутність епізодів гіпербілірубінемії, стійку ремісію шкірних проявів PCT (за умови обмеження інсоляції та відмови від алкоголю), відсутність астенічного синдрому. Щодо вірусологічної відповіді, вперше HCV-RNA зникла з крові лише на 16-му тижні противірусної терапії. Така пізня відповідь є несприятливою прогностичною ознакою, тому для оптимізації противірусної терапії, не зважаючи на нормальні показники вмісту сироваткового заліза, хворому було проведено повторні флеботомії для зменшення гемосидерозу. В результаті було досягнуто безпосередню вірусологічну відповідь ( HCV-RNA “-” на час завершення 48-тижневого курсу терапії), однак стійкої вірусологічної відповіді (6-й місяць після припинення терапії) ми не отримали. Ключову роль у неспроможності повної елімінації збудника у даному випадку, на нашу думку, могли відіграти не тільки фактор гемохроматозу, але і несприятливий генотип збудника. Проте, хворий О. не належить до так званихнон-респондентів (адже було досягнуто пізню та безпосередню вірусологічну відповідь). Тому можна прогнозувати ефективність повторного курсу противірусної терапії за модифікованою схемою з використанням пегильованих інтерферонів. Щотижневі флеботомії по 500 мл/добу дозволять суттєво розвантажити гепатоцити від надлишку заліза, що не тільки зменшить його безпосередній токсичний вплив на гепатоцити, але і оптимізує прогноз противірусної терапії. При цьому, за даними літератури, зниження феритину до 20 нг/мл, як правило, супроводжується зникненням клінічних ознак гемохроматозу та пізньої шкірної порфірії [10].
Гірший прогноз маємо у випадку брата-близнюка А., який відмовився від запропонованих схем лікування і намагається контролювати шкірні прояви порфірії лише обмеженням впливу окремих екзогенних порфіриногенів (багаті на залізо продукти, алкоголь, інсоляція). Сукупність гепатотропних чинників (віремія, гемосидероз) можуть змінити притаманний ХГС повільний перебіг хвороби і невдовзі явити картину сформованого цирозу печінки подвійної етіології.
Висновки
Виявлення А3-специфічностей у даних пацієнтів співпадає з даними літератури, які покладають відповідальність за спотворення обміну заліза на мутацію C282Y, зчеплену саме з А3-HLA-фенотипом. Тому визначення HLA-фенотипу у HCV-інфікованих пацієнтів може покращити своєчасність діагностики та ефективність лікування PCT. Маніфестація PCT на тлі ХГС повинна бути підставою для обов’язкового дослідження рівню заліза, в тому числі гістологічно з постановкою реакції Перлса. Схема лікування повинна забезпечити наступні напрямки: 1) елімінацію усіх екзогенних порфіриногенів; 2) противірусну терапію вірусних індукторів гемосидерозу; 3) патогенетичні засоби активації ферментів порфіринового обміну і корекції рівнів гему, в тому числі шляхом флеботомій.
Література
- Мороз Л.В., Турський О.Ф., Оліпер О.А., Іпатова Д.П. Гемосидероз печінки у хворих на хронічний гепатит С // Вісник морфології. – 2009.– №15(1).– С.107–110.
- Sams H, Kiripolsky MG, Bhat L, Stricklin GP. Porphyria cutanea tarda, hepatitis C, alcoholism, and hemochromatosis: a case report and review of the literature // Cutis. – 2004.– N.73(3).– P.188 –190.
- Martinelli AL, Zago MA, Roselino AM, Filho AB, Villanova MG, Secaf M, Tavella MH, Ramalho LN, Zucoloto S, Franco RF. Porphyria cutanea tarda in Brazilian patients: association with hemochromatosis C282Y mutation and hepatitis C virus infection // Am. J. Gastroenterol. – 2000.– N.95(12).–P.3516–3521
- Chiaverini C, Halimi G, Ouzan D, Halfon P, Ortonne JP, Lacour JP. Porphyria cutanea tarda, C282Y, H63D and S65C HFE gene mutations and hepatitis C infection: a study from southern France // Dermatology.– 2003.– N.206(3).–P.212-216.
- Morgan Wilson, Tammie Ferringer Porphyria cutanea tarda as the presenting sign of hereditary hemochromatosis // Journal of the American Academy of Dermatology.– 2010.– Vol. 62, Issue 3, Suppl. 1, Page AB92.
- Skowron F, Berard F, Grezard P, Wolf F, Morel Y, Perrot H. Role of the hemochromatosis gene in prophyria cutanea tarda. Prospective study of 56 cases // Ann Dermatol Venereol. – 2001.– N.128(5).– P.600–604
- Mehrany K, Drage LA, Brandhagen DJ, Pittelkow MR. Association of porphyria cutanea tarda with hereditary hemochromatosis // J. Am Acad Dermatol. – 2004.– N.51(2).– P.205–211.
- Nagy Z, Koszo F, Par A, Emri G, Horkay I, Horanyi M, Karadi O, Rumi G Jr, Morvay M, Varga V, Dobozy A, Mozsik G. Hemochromatosis (HFE) gene mutations and hepatitis C virus infection as risk factors for porphyria cutanea tarda in Hungarian patients // Liver Int. – 2004.– N.24(1).–P.16–20
- Sajid Jalil, James J. Grady, Chul Lee, Karl E. Anderson Associations among Behavior-Related Susceptibility Factors in Porphyria Cutanea Tarda // Clinical Gastroenterology and Hepatology.– 2009 Nov 27. [Epub ahead of print]
- Janet L. Kwiatkowski Oral Iron Chelators // Hematology/Oncology Clinics of North America February.– 2010– Vol. 24, Issue 1.– Pages 229–248.
Резюме
Наследственный гемохроматоз и поздняя кожная порфирия у больных с хроническим гепатитом С: взгляд на патогенез в зеркале клинических примеров.
Д.Е. Телегин
У нас была уникальная возможность сравнить течение HH и РСТ у двоих ВГС-инфицированных монозиготных близнецов. Мы исследовали четыре поколения семьи близнецов. Один из близнецов получал противовирусную терапию (alfa2b-ИФН + Rbvn). Была достигнута стойкая ремиссия РСТ и прекратилась виремия. Другой получал только патогенетическую терапию и кровопускания. Симптомы ХГС и РСТ в этом случае имеливолнообразное течение. Это исследование показало, что ВГС-инфекции является основным пусковым моментом HH и РСТ. Лечение РСТ у ВГС-инфицированных пациентов должно включать противовирусную терапию.
Ключевые слова: гепатит С, гемохроматоз, перегрузка железом, порфирия cutanea tarda.
Summary
Hereditary hemochromatosis and porphyria cutanea tarda in patients with chronic hepatitis С.
D. Ye. Telehin
We had a unique opportunity to compare a course of HH and PCT in two HCV-infected monozygotic twins. We explored four generation of the twins’ family. One of twins received antiviral therapy (alfa2b-IFN+Rbvn). A persistent remission of PCT and discontinued viremia has been achieved. The other one was only given pathogenetic and phlebotomy treatment. The symptoms of CHC and PCT in this case have undulating course. This study has shown that HCV-infection is the main trigger of HH and PCT. The management of PCT in HCV-infected patients should include antiviral therapy.
Keywords: hepatitis C, hemochromatosis, iron overload, porphyria cutanea tarda.


