Гепатологія – 2010. – № 2. – С. 81–86.
Головний форум Європейської асоціації з вивчення печінки (EASL) цьогоріч відбувся у перлині центральної Європи, казковому Відні. На відміну від минулих конференцій, що презентували переважно результати чергових стадій попередньо анонсованих клінічних досліджень, цьогорічна зустріч змогла здивувати делегатів доповідями, що пропонують неочікувано новий погляд на традиційні проблеми гепатології. Оскільки деякі представлені на віденській конференції інновації у найближчі роки можуть радикально змінити існуючі стандарти ведення хворих на хронічний гепатит С, у нашому огляді ми вирішили основну увагу приділити саме цим повідомленням.
Зауважити новий напрямок у розвитку сучасної гепатології можна переглянувши зміст програми 45-го конгресу EASL. Поряд із традиційними розділами: клінічні, експериментальні аспекти гепатитів, імунологія, трансплантація, лікування, – з’являється новий окремий розділ «Поліморфізм IL28b». Перше повідомлення на цю тему прозвучало минулої осені на конгресі Американської асоціації з вивчення хвороб печінки (AASLD) у Бостоні, майже одночасно із сенсаційною публікацією у журналі “Nature” D. B. Goldstein, J. G. McHutchison, A. J. Thompson та співавторів. У своїй статті «IL28b асоціюється із відповіддю хронічного гепатиту С на лікування α-інтерфероном та рибавірином» вони повідомили, що ефективність противірусної терапії (ПВТ) в осіб із СС-генотипом є удвічі вищою, ніж у хворих із не-СС-генотипом (а саме, СТ- або ТТ-генотипами). І ось вже навесні 2010 року, у Відні, ми можемо чути нові повідомлення про зв’язок стійкої вірусологічної відповіді (СВВ) із поліморфізмом IL28 (rs12979860) у хромосомі 19q13, що кодує інтерферон l3; про поширеність генотипів СС, СТ, ТТ у регіонах світу; їх зв’язок із внутрішньопечінковою експресією інтерферон-індукованих генів і, навіть, із ймовірністю спонтанного кліренсу HCV. Як вплине виявлена генетична схильність того чи іншого пацієнта щодо СВВ на засади ПВТ, особливо напередодні появи на ринку противірусних засобів нових генерацій, спробуємо розібратись, спираючись на повідомлення 45-го конгресу EASL.
Вже на першому пленарному засіданні EASL один з авторів публікації у «Nature», A.Thompson, презентував результати генетичного обстеження 74 хворих на хронічний гепатит С, переважно 1 генотипу [1]. В усіх пацієнтів визначали СС-, СТ- та ТТ-генотип IL28, і у подальшому аналізували рівні внутрішньопечінкової експресії інтерферон-індукованих генів (ІІГ) серед хворих із СС- та не-СС-генотипом. Одержані результати виявили чіткий зв’язок між СС-генотипом IL28 та зниженням експресії ІІГ. Обидві ці ознаки корелювали також із частотою СВВ, що дозволило авторам припустити існування генетичнодетермінованих варіантів імунної відповіді на HCV-інфікування та на ефективність подальшої інтерферонотерапії. Аналогічні результати продемонстрували роботи японських [2] та французьких вчених [3], однак їх швейцарські колеги більш схильні розглядати генотип IL28 та рівень експресії ІІГ як незалежні предиктори, наголошуючи на вищій прогностичній цінності останнього [4].
Продовжуючи тему генетичних предикторів відповіді на противірусну терапію, слід відзначити ще одну роботу. Вона, як і попередні, розпочиналась у рамках дослідження IDEAL. Символічно, що цей грандіозний проект, намагаючись порівняти ефективність та переносимість різних молекул та схем використання пегильованих інтерферонів, виявив відмінності значно суттєвіші, ніж очікувалось. Проте, далеко не ті, що залежать не від екзогенних факторів (препарату чи схеми його дозування), але від спадкових ознак пацієнта. У своїй роботі D. B. Goldstein, J. G. McHutchison, A. J. Thompson із співавторами повідомляють про виявлений однонуклеотидний поліморфізм гену, що кодує фермент інозинтрифосфатазу (ITPA) – rs1127354 та rs7270101. Наявність мінорних алелей у пацієнтів, за даними авторів, зумовлювала дефіцит ITPA, що, у свою чергу, запобігало розвитку рибавірин-індукованої гемолітичної анемії, проте не впливало на частоту стійкої вірусологічної відповіді [5].
Окреслюючи перспективи вдосконалення противірусної терапії у найближчому майбутньому і, відповідно, прогнозуючи зростання ефективності терапії ХГС з 40% (у разі найнесприяливішого 1-м генотипа HCV) до 80%, професор John McHutchison презентував стратегію ПВТ із урахуванням вище перерахованих генетичних предикторів СВВ – визначення поліморфізму генів IL28b та ITPA (рис. 1). Третьою складовою оптимізації терапії майбутнього він називає доповнення існуючих схем препаратами прямої антивірусної дії (Direct Acting Anti-Viral, DAA).
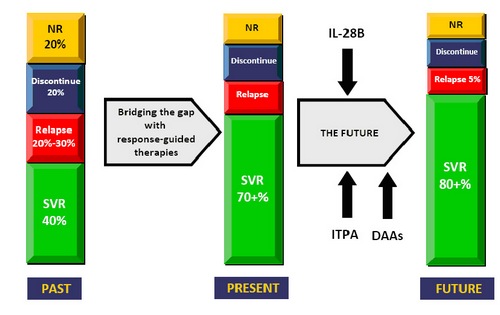
Рисунок 1. Перспективи ПВТ ХГС (за даними John McHutchison, MD Duke University Medical Center, Durham, North Carolina, USA // The International Liver Congress 2010 45th annual meeting of the European Association for the Study of the Liver April 14-18, 2010, Vienna, Austria).
З очікуваних сьогодні засобів прямої антивірусної дії найбільші надії покладають на два препарати з групи інгібіторів протеази NS3/4a – боцепревір (MSD) і телапревір (Vertex Pharmaceuticals), що знаходяться на завершальній стадії третьої фази клінічних досліджень і незабаром будуть зареєстровані для клінічного застосування. Представлені у Відні результати досліджень цих препаратів підтверджують їх перспективність. Так, у повідомленні Vierling JM і співавторів було підтверджено тривалість СВВ при терапії пегінтерфероном α2b, рібавіріном і боцепревіром: у жодного з 290 пацієнтів, що брали участь в дослідженнях II фази і досягли СВВ, при понад, ніж 2-річному спостереженні не розвинулось віддалених рецидивів. Побічні ефекти, специфічні для боцепревіру, такі як порушення смаку і розвиток анемії, було зареєстровано лише у 5% пролікованих. Це дозволяє стверджувати, що СВВ після курсу потрійної терапії із використанням боцепревіру, є маркером остаточного кліренсу вірусу з організму пацієнта. Раніше результати 2-ї фази клінічних випробувань боцепревіру у дозі 800 міліграм 3 рази на день показали, що його комбінація із пегинтерфероном α2b і рібавіріном у стандартних дозуваннях протягом 48 тижнів у хворих на ХГС 1b генотипу, може забезпечувати СВВ у 72% хворих. У цій групі використовувався спеціальний режим терапії: пацієнти отримували стартову терапію лише пегінтерфероном і рибавірином протягом 4 тижнів, а потім до стандартної терапії додавався боцепревір, і лікування продовжувалося до 48 тижнів. Такий режим терапії мав декілька переваг. Ключовою є можливість досягти початкового пригнічення реплікації HCV і знизити ризик появи і селекції мутацій, резистентних до боцепревіру, а також виявити пацієнтів, в яких можна утриматись від призначення третього препарату. У разі ж його призначення можливе скорочення загальної тривалості терапії до 28 тижнів. Так, у групі пацієнтів, досягнувших кліренсу ВГС на 4-му тижні лікування пегінтерфероном, рибавірином і боцепревіром (8 тиждень загального курсу терапії), частота досягнення УВО після 24-тижневого лікування склала 82 %. У рамках сателітарного симпозіуму доктор Fred Poordad з медичного центру Лос-Анджелесу навів також дані дослідження SPRINT-1, що переконують в ефективності боцепревіру у разі лікування невідповідачів на стандартну ПВТ: частота СВВ при 48-тижневому курсі потрійної терапії таких хворих може сягати 55%, за умови наявності в них швидкої вірусологічної відповіді [7]. Дослідження, PROVE-1, яке вивчало ефективність іншого інгібітора протеази – телапревіру, показало середню частоту СВВ 37% серед невідповідачів на попередній курс стандартної ПВТ та 57% – серед хворих, що перервали попередній курс ПВТ [8]. Препарати з інших фармакологічних груп, що знаходяться на ранніх стадіях клінічних досліджень і поява яких очікується у віддаленій перспективі, теж були анонсовані у доповіді Stefan Zeuzem і схематично представлені на рисунку 2.
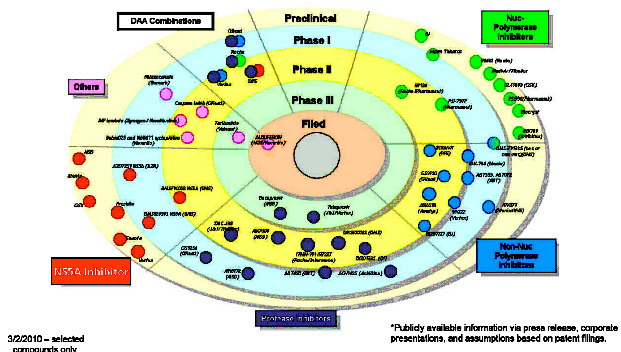
Рисунок 2. Препарати прямої противірусної дії, що у даний час знаходяться на І-ІІІ стадіях клінічних досліджень (за даними Stefan Zeuzem MD, J.W.GoetheUniversity Hospital Frankfurt, Germany // The International Liver Congress 2010 45th annual meeting of the European Association for the Study of the Liver April 14-18, 2010, Vienna, Austria).
Аналізуючи наслідки цих здобутків у діагностиці та лікуванні хронічного гепатиту С: можливість генетичного прогнозування СВВ та появу нових препаратів з групи інгібіторів протеаз, усвідомлюєш, що прогрес у гепатології, як і у будь-якій іншій галузі, породжує значно більше питань, ніж надає відповідей. Зокрема, залишаються без відповіді запитання, що були поставлені John McHutchison на одній із сесій віденської конференції: 1) чи лікуватимемо ми завтра тих хворих, у яких вже сьогодні можемо достеменно констатувати мізерність шансів на одужання? 2) кому і за яких умов завтра ми доповнюватимемо ПВТ засобами прямої противірусної дії, а кого залишатимемо на стандартній комбінації пегильованих інтерферонів і рибавірину?
Неможливо оминути увагою і інші доповіді 45-ї конференції EASL, що стосуються хронічного гепатиту С. Zeuzem S. доповів про виявлену залежність між частотою інсулінорезистентності та першим генотипом HCV. Підтвердив цей зв’язок A.Thompson у роботі, яка демонструє достовірне зниження індексу HOMA і, відповідно, інсулінорезистентності у разі досягнення СВВ саме при ХГС першого генотипу, чого, однак, не спостерігається при 2 та 3 генотипах HCV [9].
Результати багатоцентрового рандомізованого дослідження INDIV-2 презентував C. Sarrazin із співавторами. Дослідники пропонують можливість максимальної індивідуалізації тривалості ПВТ залежно від початкового вірусного навантаження та його динаміки у ході терапії. У дослідження було включено 613 хворих на ХГС 1b генотипу, що раніше не отримували ПВТ. 389 пацієнтів отримували індивідуалізовану терапію пегінтерфероном α2b і рибавірином протягом 24, 30, 36, 42, 48, 60 або 72 тижнів залежно від початкового вірусного навантаження та термінів досягнення авіремії (4, 6, 8, 12 та 24 тижні). Інші 224 хворих склали контрольну групу і отримували лікування аналогічними препаратами протягом 48 тижнів. Частота СВВ в обидвох групах виявилась ідентичною (53% та 48% відповідно), що дозволило авторам пропонувати впровадження індивідуалізованих схем ПВТ пегінтерфероном α2b та рибавірином залежно від початкового вірусного навантаження та термінів кліренсу HCV-RNA. Такі схеми, на думку авторів, дозволять знизити вартість лікування та зменшити кількість побічних ефектів без зниження ефективності ПВТ [10].
Теми індивідуалізації ПВТ за рахунок збільшення її тривалості до 72 тижнів у хворих із повільною вірусологічною відповіддю також торкалось повідомлення M. Buti із співавторами, присвячене результатам дослідження SUCCESS. Одержані у ході дослідження результати дозволили визначити ті категорії хворих, в яких подовження термінів ПВТ до 72 тижнів може достовірно збільшити шанси на досягнення СВВ. До цієї категорії автори зараховують пацієнтів, в яких на 8 тижні лікування вірусне навантаження зменшується менш, ніж на 2 log та/або на 12 тижні лікування – менш, ніж на 2-3 log [11].
Нажаль, формат інформаційного повідомлення не дозволяє достатньо повно висвітлити усі теми, що були презентовані на 45-й конференції Європейської асоціації з вивчення печінки у Відні. На окрему увагу, безперечно, заслуговує проблема хронічного гепатиту В, якій було присвячено понад 200 доповідей, проблема захворювань печінки мікст-етіології, декомпенсованих захворювать печінки, гепатоцелюлярної карциноми та інших актуальних питань гепатології.
Наступна конференція EASL запланована на 30 березня 2011 року у м. Берлін.
Література
- Abstract: 3 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S2 IL28B POLYMORPHISM IS ASSOCIATED WITH INTRAHEPATIC ISG EXPRESSION AND PEGINTERFERON-A/RIBAVIRIN RESPONSE RATE IN CHRONIC HCV INFECTION A. Thompson, D. Schuppan, T. Urban, J. Fellay, K. Shianna, J. McHutchison, D. Goldstein, N. Afdhal
- Abstract: 1163 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S449 COMMON VARIATION OF IL28 AFFECTS INTRAHEPATIC EXPRESSION OF INTERFERON STIMULATED GENES AND CORRELATES WITH EFFECT OF PEG-INTERFERON AND RIBAVIRIN COMBINATION THERAPY H. Abe, C.N. Hayes, H. Ochi, T. Maekawa, M. Tsuge, D. Miki, F. Mitsui, N. Hiraga, M. Imamura, S. Takahashi, K. Chayama
- Abstract: 1167 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S451 IL-28 GENE VARIATION PREDICTS WHO WILL RESPOND TO INTERFERONBASED TREATMENT OF CHRONIC HEPATITIS C IN A FRENCH COHORT P. Halfon, M. Bourliere, D. Ouzan, C. Renou, C. Wartelle, G. Penaranda, A. Tran, D. Botta, V. Oules, P. Castellani, I. Porta, L. Argiro, A. Dessein
- Abstract: 1187 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S461 IFN STIMULATED GENE EXPRESSION IN THE LIVER IS A BETTER PREDICTOR OF TREATMENT RESPONSE IN CHRONIC HEPATITIS C THAN THE IL28B (IFN .3) GENOTYPE M.T. Dill, F.H.T. Duong, J.E. Vogt, S. Bibert, P.-Y. Bochud, L. Terracciano, A. Papassotiropoulos, V. Roth, M.H. Heim
- Abstract: 2015 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S470 GENOME WIDE ANALYSIS OF PATIENTS FROM THE IDEAL STUDY IDENTIFIES A CAUSAL ROLE FOR ITPA GENETIC VARIATION IN RIBAVIRININDUCED HEMOLYTIC ANEMIA A.J. Thompson, J. Fellay, D. Ge, T. Urban, K. Shianna, M. Sulkowski, A. Muir, N. Afdha, I. Jacobson, R. Esteban, F. Poordad, E. Lawitz, J. Mc Cone, M. Shiffman, G. Galler, W. Lee, R. Reindollar, J. King, P. Kwo, R. Ghalib, B. Freilich, L. Nyberg, K. Pate, H. Tillmann, S. Noviello, N. Bopari, K. Koury, L. Pedicone, C. Brass, J.K. Albrecht, D. Goldstein, J.G. Mc Hutchison
- Abstract: 2016 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S470 LONG-TERM OUTCOMES FOLLOWING COMBINATION TREATMENT WITH BOCEPREVIR PLUS PEG-INTRON/RIBAVIRIN (P/R) IN PATIENTS WITH CHRONIC HEPATITIS C, GENOTYPE 1 (CHC-G1) J.M. Vierling, R. Ralston, E.J. Lawitz, J. McCone, S. Gordon, D. Pound, M. Davis, J. Galati, I. Jacobson, L. Rossaro, F.H. Anderson, J. King, W. Cassidy, M. Bourliere, R. Esteban-Mur, N. Ravendhran, G. Galler, P. Mendez, C.A. Brass, J.K. Albrecht
- Kwo P, et al “Response-guided therapy (RGT) for boceprevir (Boc) combination treatment? Ð Results from HCV SPRINT-1” Hepatology 2009; 50: 1035A-1036A.
- Abstract: 4 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S2 SVR WITH TELAPREVIR, PEGINTERFERON ALFA-2A AND RIBAVIRIN IN HCV PATIENTS WITH WELL-CHARACTERIZED PRIOR NULL RESPONSE, PARTIAL RESPONSE, VIRAL BREAKTHROUGH OR RELAPSE AFTER PR T. Berg, J.G. McHutchison, N. Adda, F. Poordad, M.L. Shiffman, P. Ferenci, J. Heathcote, J.-M. Pawlotsky, S. Zeuzem, H. Reesink, G. Dusheiko, E. Martin, D. Alexanderian, S. George, A.J. Muir
- Abstract: 53 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S25 RELATION BETWEEN SUSTAINED VIROLOGIC RESPONSE AND INSULIN RESISTANCE IN PATIENTS WITH GENOTYPE 1 OR 2/3 CHRONIC HEPATITIS C A. Thompson, M. Diago, G. Foster, P. Ferenci, Y. Lurie, C. Stanciu, M. Jablkowski, D. Haussinger, P. Urbanek, S. Pianko, W.-L. Chuang, G. Subramanian, J. McHutchison
- Abstract: 54 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S25 COMPLETELY INDIVIDUALIZED TREATMENT DURATIONS (24, 30, 36, 42, 48, 60 OR 72 WEEKS) WITH PEGINTERFERON-ALFA-2B AND RIBAVIRIN IN HCV GENOTYPE 1-INFECTED PATIENTS (INDIV-2 STUDY) C. Sarrazin, S. Schwendy, B. Moller, N. Dikopoulos, P. Buggisch, J. Encke, G. Teuber, T. Goeser, R. Thimme, H. Klinker, W.O. Boecher, E. Schulte-Frohlinde, R. Prinzing, T. Berg, S. Zeuzem
- Abstract: 247 Citation: Journal of Hepatology, Supplement No 1, Volume 52, 2010, Page S104
- PREDICTING TREATMENT OUTCOME AMONG SLOW RESPONDERS: A RETROSPECTIVE ANALYSIS OF THE SUCCESS STUDY M. Buti, V.G. Morozov, V.V. Rafalskiy, F. Wong, J. Sumskiene, X. Yu, R. Faruqi, L.D. Pedicone, R. Est.


